转自:生物谷
在癌症治疗领域,CAR-T细胞疗法无疑是一颗耀眼的“明星”。作为革命性的免疫治疗手段,它在血液系统恶性肿瘤(如淋巴瘤、白血病)中创造了诸多“治愈”奇迹——部分患者在接受治疗后实现长期缓解,甚至临床治愈。然而,这一疗法并非完美无缺:尽管初始反应率可高达70%以上,但超过60%的患者会在1-2年内复发,长期缓解率仅维持在30%-40%。全球每年新增数十万血液系统恶性肿瘤患者,如何突破CAR-T疗法的“持久性瓶颈”,成为医学界亟待解决的关键问题。
近日,发表在《MolecularCancer》杂志上的一项研究为这一难题带来了新答案。来自梅奥诊所等机构的科学家团队发现:细胞衰老或许是CAR-T疗法失败的“隐形杀手”,而CAR-T细胞中“共刺激域”的差异,直接决定了其是否容易陷入衰老状态——这一发现为优化CAR-T疗法、延长疗效持久性开辟了全新路径。

CAR-T细胞的“命运开关”
CAR-T细胞疗法的核心是对患者自身T细胞进行基因改造,使其表达“嵌合抗原受体(CAR)”,从而精准识别并杀伤癌细胞。而CAR结构中的“共刺激域”,相当于T细胞的“加速器”,负责调控其激活、增殖和存活能力。目前临床常用的CAR-T细胞主要搭载两种共刺激域:4-1BB-CD3ζ(简称BBζ)和CD28-CD3ζ(简称28ζ)。
过去的研究认为,BBζ和28ζ的差异主要体现在“活性持续时间”上:BBζ激活较温和但持久,28ζ初始激活强烈但持续时间短。而这项新研究则揭示了更关键的区别:面对反复激活(模拟体内与癌细胞的持续“战斗”),两种CAR-T细胞的“衰老抵抗力”截然不同。
反复激活/静息或会损害CAR-T细胞的活性
BBζ为何更“脆弱”?
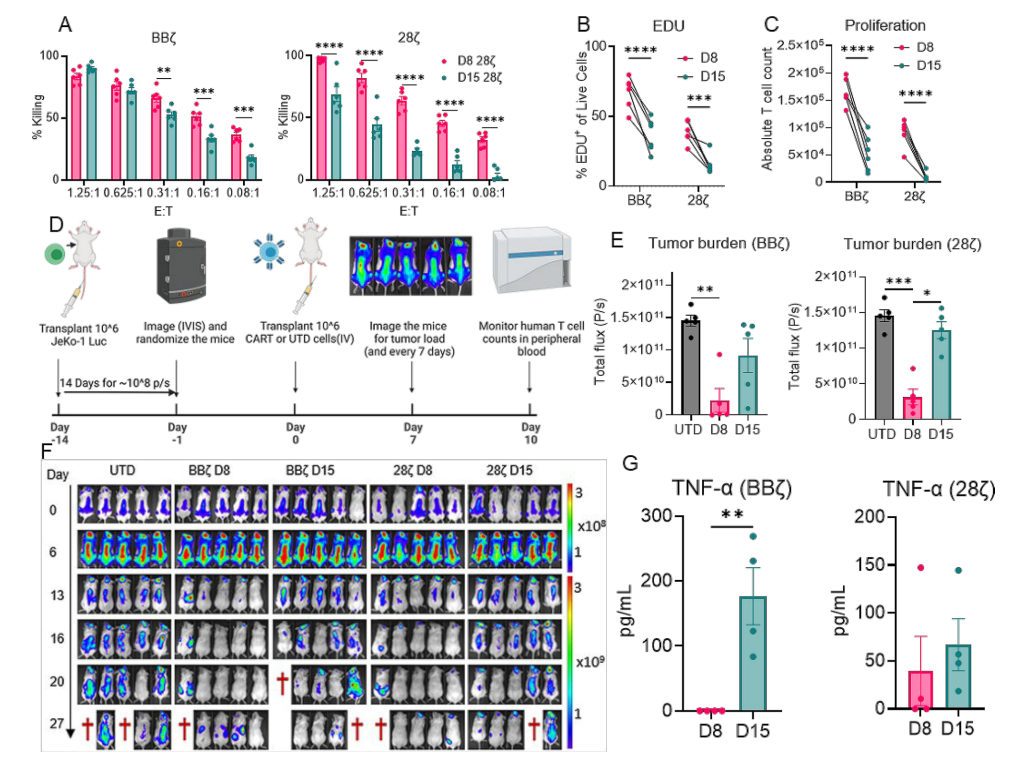
为模拟癌症复发过程,研究团队设计了一套“反复激活-休息”体外模型:让CAR-T细胞多次接触癌细胞(激活),随后进入休息期,以此观察其功能变化。实验对象为表达CD19靶向CAR的BBζ和28ζ细胞(均来自健康供体T细胞改造),结果发现了显著差异:
●衰老标志物:经过反复激活后,BBζ细胞中衰老标志物(p21、KLRG1、uPAR等)的表达量显著高于28ζ。例如,p21阳性细胞比例在BBζ中上升了约40%,而28ζ仅上升15%;uPAR(衰老细胞表面标志物)的表达量在BBζ中是28ζ的2.3倍。
●端粒缩短与DNA损伤:端粒长度是细胞衰老的“生物钟”。实验显示,BBζ细胞在反复激活后端粒长度缩短了约30%,而28ζ仅缩短10%;同时,BBζ中DNA损伤标志物(p-H2AX、p-ATM等)的水平是28ζ的3倍以上,表明其基因组稳定性更差。
●功能“断崖式下跌”:体外杀伤实验中,BBζ对癌细胞的杀伤率从初始的85%降至40%,而28ζ仍保持65%以上的杀伤活性;动物模型(移植淋巴瘤细胞的小鼠)中,接受BBζ治疗的小鼠肿瘤复发时间比28ζ提前了约10天,生存期缩短近40%。
为进一步验证“衰老导致BBζ功能衰退”,研究团队通过两种独立方法诱导CAR-T细胞衰老,结果再次印证了共刺激域的差异影响:
●MYC激活实验:MYC是一种促癌基因,其过度激活会诱导细胞衰老。研究发现,当人为激活MYC后,BBζ细胞的衰老标志物表达量上升了50%,杀伤活性下降至原来的1/3;而28ζ仅出现轻微衰老,功能几乎不受影响。
●辐射诱导衰老:低剂量辐射(3Gy)会造成DNA损伤,触发衰老。实验显示,辐射后BBζ的杀伤能力下降60%,而28ζ反而提升了15%的杀伤活性——这一结果与临床数据吻合:接受28ζ疗法(axi-cel)的患者中,高衰老评分者的无进展生存期更长。
让CAR-T更“耐用”
研究还分析了临床患者数据,发现:在接受BBζ疗法(tisa-cel)的患者中,治疗前CAR-T细胞的“衰老签名”(如senMayo基因集高表达)与复发风险正相关——高衰老签名患者的复发率是低签名患者的3倍;而在28ζ疗法(axi-cel)中,这一关联完全消失,甚至高衰老签名患者的疗效更优。
这些发现为CAR-T疗法优化提供了明确方向:
1.筛选“低衰老潜能”CAR结构:优先选择28ζ共刺激域,或改造BBζ以增强抗衰能力;
2.联合“senolytics(衰老细胞清除剂)”:在BBζ治疗中加入可清除衰老细胞的药物,减少功能衰退;
3.精准监测衰老标志物:通过p21、uPAR等指标预测疗效,提前干预高风险患者。
小结
这项研究首次揭示了“共刺激域决定CAR-T细胞衰老易感性”的关键机制,不仅解释了为何BBζ疗法更容易复发,更为开发更持久的CAR-T疗法提供了“靶点”。未来,随着对细胞衰老调控的深入探索,CAR-T疗法有望从“短期有效”迈向“长期治愈”,为更多血液肿瘤患者带来希望。
参考文献:
Can,I.,Siegler,E.L.,Sirpilla,O.L.etal.DifferentialsusceptibilityandroleforsenescenceinCARTcellsbasedoncostimulatorydomains.MolCancer24,172(2025).doi:10.1186/s12943-025-02371-1