药物临床试验登记信息显示,南京海纳制药有限公司的芦曲泊帕片在中国健康人群中单次给药的人体生物等效性临床试验已启动。临床试验登记号为CTR20253034,首次公示信息日期为2025年8月1日。
该药物剂型为片剂,用法为约240mL水送服1片,单次给药,每周期给药一次,共两周期。本次试验主要目的是以持证商为ShionogiInc.的芦曲泊帕片为参比制剂,评价受试制剂与其在中国健康受试者中空腹和餐后状态下的生物等效性;次要目的是观察受试制剂和参比制剂在中国健康受试者中的安全性。
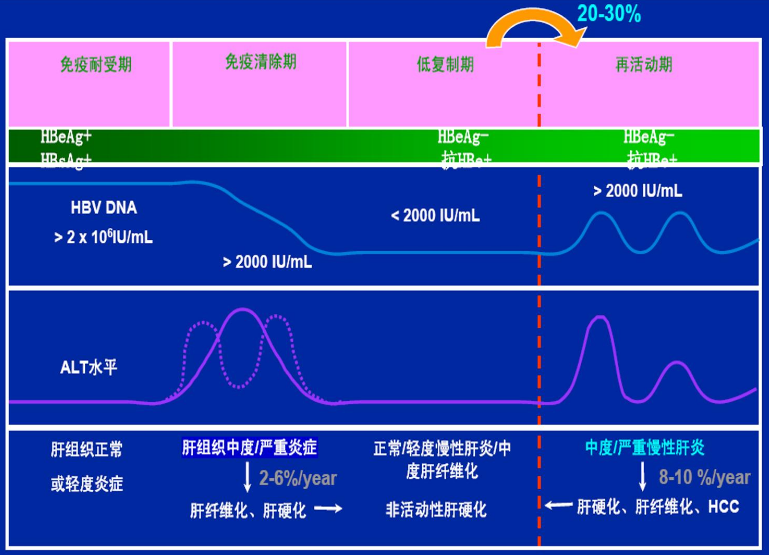
芦曲泊帕片为化学药物,适应症为计划接受手术(含诊断性操作)的慢性肝病伴血小板减少症的成年患者。慢性肝病是指肝脏发生慢性炎症或损伤,血小板减少症会导致凝血功能异常,容易出现出血症状,诊断主要依靠血液检查。
本次试验主要终点指标包括主要PK参数:Cmax、AUC0-72hr;次要终点指标包括次要PK参数:Tmax、λz、T1/2、CL/F、Vd/F、F;安全性评价指标:生命体征、体格检查、不良事件、实验室检查值、12-导联心电图。
目前,该实验状态为进行中(尚未招募),目标入组人数48人。
风险提示:市场有风险,投资需谨慎。本文为AI大模型基于第三方数据库自动发布,任何在本文出现的信息(包括但不限于个股、评论、预测、图表、指标、理论、任何形式的表述等)均只作为参考,不构成个人投资建议。受限于第三方数据库质量等问题,我们无法对数据的真实性及完整性进行分辨或核验,因此本文内容可能出现不准确、不完整、误导性的内容或信息,具体以公司公告为准。如有疑问,请联系biz@staff.sina.com.cn。