内烯烃广泛存在于天然产物和药物中,并且在有机合成中具有重要价值。然而,传统的内烯烃合成方法,如Wittig反应、Horner-Wadsworth-Emmons (HWE) 反应和Peterson烯化反应等,通常需要较多的步骤和试剂,存在原子经济性较低的问题。此外,近年来出现的α-烯烃异构化、烯丙基C-H活化、Heck氧化偶联等方法尽管可以提供替代策略,但仍然面临选择性和适用性受限的问题。因此,开发高效、原子经济性强且具有区域选择性的合成策略仍然是当前催化和有机合成领域的关键挑战之一。
成果简介基于此,四川大学董顺喜教授团队提出稀土金属催化的Anti-Markovnikov氢烯丙基化策略,实现了苯乙烯衍生物与1-芳基-2-烷基烯烃或α-烯烃的高效C-H活化反应,构建了一系列内烯烃化合物(65种实例,产率最高可达99%,E/Z比>19:1)。该研究以“Anti-Markovnikov hydroallylation reaction of alkenes via scandium-catalyzed allylic C‒H activation”为题,发表在《Nature Communications》期刊上。


董顺喜,博士毕业于四川大学,师从冯小明教授。2013作为洪堡学者赴德国亚琛工业大学Carsten Bolm教授课题组开展博士后研究工作,主要从事氨基酸衍生的pentathiepin设计合成以及手性氮杂环卡宾(NHC)催化不对称转化领域研究。2016年,加入德国明斯特大学Gerhard Erker(德国科学院院士、欧洲科学院院士)课题组,开展新型受阻Lewis酸碱对(FLP)的设计合成及其反应性研究。2018年加入四川大学化学学院,主要从事(1)手性双氮氧/金属配合物催化;(2)新型手性稀土金属有机配合物催化剂设计合成及其在不对称C-H官能化、氢元素化等反应中的应用研究。截至目前,已取得一系列创新性的研究成果,在Acc. Chem. Res., Chem. Soc. Rev., J. Am. Chem. Soc., Angew. Chem. Int. Ed., CCS Chem., ACS Catal., Sci. China Chem., J. Med. Chem., Org. Lett., Chem. Commun.等刊物发表SCI论文40余篇,多篇工作被Synfacts杂志专题亮点评述。
研究亮点1、高效稀土催化策略:采用阳离子咪唑啉-2-亚胺配体的Sc(III)烷基催化剂,实现了苯乙烯衍生物的Anti-Markovnikov选择性氢烯丙基化,产率高达99%,E/Z比>19:1。
2、多样化底物适应性:该反应适用于多种1-芳基-2-烷基烯烃、α-烯烃及苯乙烯衍生物,并且对取代基的影响具有高度耐受性,能够有效避免双键迁移或副反应。
3、机理研究深入:结合实验和DFT理论计算,阐明了烯丙基C-H活化、双键插入及σ-键交换的催化循环,揭示了Lewis碱辅助对E/Z选择性的调控作用,并确定了σ-键交换为速率决定步骤。
图文导读
图1 烯烃的烯丙基C−H键功能化
图1展示了本研究的催化策略及其背景和机理。首先,图1a展示了一系列天然产物和生物活性分子中含有的内烯烃结构,这些化合物在医药化学和材料科学中具有重要应用。由于内烯烃合成通常需要复杂的合成步骤,因此开发高效的直接合成策略至关重要。图1b对比了CuH催化的Markovnikov型氢烯丙基化反应,该反应通常依赖于亲电烯丙基化途径,并倾向于形成α-烯烃产物,而较少涉及Anti-Markovnikov选择性的方法。
图1c 强调了本研究提出的稀土催化Anti-Markovnikov氢烯丙基化策略,这一策略基于稀土金属(RE)与烯烃的π键相互作用(RE...π),增强了烯丙基氢的酸性,促进了精准的C-H活化反应。整个催化循环包括烯丙基C-H活化、烯烃插入以及σ-键交换,最终生成链增长的内烯烃。该策略的优势包括高产率(最高可达99%)、E/Z选择性可控(最高>19:1)、广泛的底物适用性,为高效合成内烯烃提供了一种全新的方法学基础。

图2 内烯烃A和苯乙烯B的底物范围
图2阐述了该催化体系在不同底物上的适用性,考察了苯乙烯(B1)和不同的1-芳基-2-烷基烯烃(A1-A11)之间的反应。实验表明,该体系能够有效地催化各种β-取代苯乙烯衍生物(如A1-A11),形成相应的内烯烃产物(D1-D11),其中产率最高可达99%,E/Z比最高可调控至>19:1。这表明该催化体系对于不同取代基(如烷基、芳基、卤素及杂原子取代基)具有良好的耐受性,能够适应不同的电子效应和空间效应。值得注意的是,一些含有杂原子的底物(如甲氧基、硫代甲基、氨基取代苯乙烯)仍然能够顺利发生反应,这表明催化剂对Lewis碱基团的耐受性较强。此外,该反应体系也适用于不同类型的β-乙基取代苯乙烯,并且随着取代基体积增大,产率会有所下降,说明空间效应可能对催化效率有一定影响。
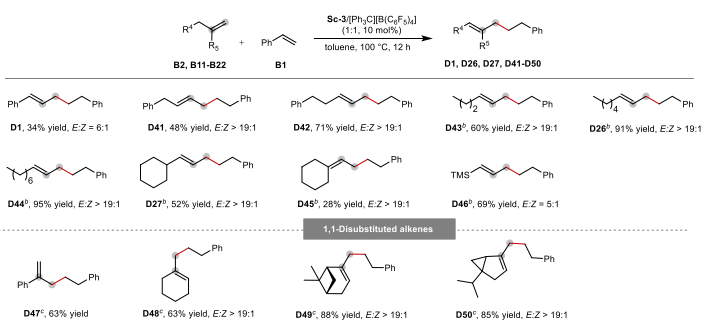
图3 端烯烃B2和B11‒B22与苯乙烯B1的底物范围
图3探讨了端烯烃在该催化体系下的双键迁移和后续氢烯丙基化反应。实验发现,端烯烃(如烯丙基苯B2)在Sc(III)催化下首先发生双键迁移,生成2-烯烃中间体,随后与苯乙烯(B1)发生氢烯丙基化反应,最终得到链增长的内烯烃(D41-D50)。这一策略特别适用于各类端烯烃,包括芳基取代烯烃、硅基取代烯烃及1,1-二取代烯烃,表明Sc催化剂对双键迁移和C-H活化的高度选择性。此外,该催化体系能够控制双键迁移的方向,确保最终产物为2-烯烃,而不会进一步发生异构化或副反应。值得注意的是,该体系适用于不同类型的端烯烃,特别是含有硅基和杂原子取代基的烯烃,在反应过程中仍能保持较高的E/Z选择性。

图4 内烯烃和端烯烃二聚的底物范围
图4深入探讨了该催化体系在高底物浓度条件下的烯烃二聚化。在浓度较高的条件下,β-甲基苯乙烯(A1)在Sc-3或Sc-11的催化作用下,可以通过烯丙基C-H活化和烯烃插入机制,选择性生成二聚化产物(C1-C10)。实验发现,加入THF可以提高E/Z选择性,可能是因为THF能够影响烯丙基-Sc配合物的几何构型,减少立体阻碍,从而提高产物的选择性。此外,不同的取代基对二聚化的影响也表明,某些取代基(如长链烷基或杂原子取代基)可能会抑制二聚化反应,而导致副反应或聚合反应的发生。

图5 合成应用
图5展示了该催化策略在实际合成中的应用潜力,并探讨了其在复杂分子合成中的可拓展性。实验表明,该反应可在克级规模上进行,并且在放大过程中仍保持高产率和高E/Z选择性。例如,以12 mmol的A8与4 mmol的B1进行反应,可获得90%产率的D8(1.14 g),这表明该方法具有工业化应用的潜力。此外,该催化体系所得的内烯烃还可以进一步进行多种官能团转化,如环氧化、二羟基化、氢硅化、光催化环丙烷化、Suzuki偶联和C-H烷基化,证明该方法学在药物化学和材料合成中的广泛应用前景。

图6 机械调查
图6通过一系列实验和理论计算验证了反应机理。首先,实验表明β-甲基苯乙烯(A1)在Sc(III)催化下会发生E/Z互变,暗示催化过程中可能存在动态平衡。其次,氘标记实验(KIE = 4.2)确认σ-键交换为速率决定步骤。此外,DFT计算揭示了反应路径,确认烯丙基C-H活化通过σ-键交换发生,而烯烃插入则决定了E/Z选择性。此外,计算表明Lewis碱(如THF)可以影响E/Z选择性,提高产物的立体控制。
总结展望本研究开发了一种基于稀土催化的Anti-Markovnikov氢烯丙基化策略,实现了苯乙烯与烯烃的高效C-H活化反应,合成了一系列链增长的内烯烃化合物,并表现出优异的底物普适性、区域选择性和E/Z选择性(最高>19:1)。此外,实验和DFT计算深入揭示了催化机理,阐明了稀土金属与烯烃的相互作用对于C-H活化及选择性的影响。该策略可进一步拓展至手性催化体系,用于构建不对称内烯烃化合物。同时,结合稀土催化的C-H官能化反应,或可实现更高效的复杂分子合成。本研究为绿色化学和高效合成提供了一种新的方法学基础。
文献信息Anti-Markovnikov hydroallylation reaction of alkenes via scandium-catalyzed allylic C‒H activation. Nature Communications, https://doi.org/10.1038/s41467-025-56602-6.
