2024年2月26日,TScan Therapeutics生物制药公司在美国移植和细胞治疗学会(ASTCT)和国际血液和骨髓移植研究中心(CIBMTR)的移植和细胞治疗会议上,介绍了评估两款新的TCR-T疗法产品:TSC-100和TSC-101的Ⅰ期最新临床研究数据(NCT05473910),该试验旨在治疗急性髓性白血病(AML)、骨髓增生异常综合征(MDS)或急性淋巴细胞白血病(ALL) (NCT05473910)患者造血细胞移植(HCT)后的残留疾病和预防复发。

最新结果显示:所有8名接受TSC-100或TSC-101治疗的患者没有出现复发。其中4名患者已经接受了10个多月的研究。一名携带TP53基因突变的高风险MDS患者在接受TSC-101治疗后已经无复发超过1年。
TSC-100和TSC-101是TScan Therapeutics公司开发的TCR-T细胞疗法,分别靶向次要组织相容性抗原HA-1和HA-2。它们旨在与同种异体的造血细胞移植(HCT)联用,消灭残余血液癌细胞,预防疾病复发。
在该数据中,我们可以发现所有8名患者在每个时间点都实现并保持了完全的供体嵌合,其中4名患者超过了10个月的标志。这对这些患者来说是一个非常好的迹象,十分的鼓舞,期待着后续的数据。
关于TCR-T
TCR-T细胞疗法也是过继细胞转移疗法(ACT)的一种,通过筛选和鉴定能特异性结合靶抗原的TCR序列,利用基因工程改造来自患者外周血的T细胞,然后将改造后的T细胞回输至患者体内,使其能特异性识别并杀伤表达抗原的肿瘤细胞,从而达到治疗肿瘤的目的。T细胞受体工程化T细胞疗法(TCR-T)治疗不受靶细胞表面抗原表达的限制,是一种潜在的肿瘤细胞免疫治疗方法。可广泛用于治疗包括实体瘤在内的多种恶性肿瘤细胞,在肿瘤治疗方面也显示出巨大的潜力。

典型病例
一名71岁女性患者在胰腺炎和胆道狭窄反复发作后,于67岁时被诊断为胰腺头部腺癌,并在2019年在肺右下叶的一个扩大的结节中进行细针穿刺,发现了肺转移的存在。2021年6月患者接受了自体外周血T细胞治疗。
细胞输注后第21天绝对中性粒细胞计数恢复,第28天血小板恢复。在细胞输注1个月后的第一次临床随访中,通过计算机断层扫描观察到患者的转移性肺病变消退,根据实体肿瘤反应评价标准(RECIST)1.1版,总体客观部分缓解62%。在细胞移植后6个月的最新随访中,肿瘤仍在继续消退,根据1.1版RECIST,总体部分缓解率为72%。

由此可见TCR-T疗法的疗效。
截至目前,TCR-T细胞免疫疗法已在部分实体肿瘤治疗中,取得了较满意的疗效。当然TCR-T除了以上两款产品之外,还有很多产品非常让人期待,如靶向HBV抗原的SCG101、TC-N201以及CRTE7A2-01等。
关于SCG101
SCG101是星汉德生物依靠其专有技术平台自主研发的全球首创靶向HBV抗原的TCR-T细胞疗法,通过引入病毒特异性TCR基因序列重定向T细胞,使其表达针对乙肝病毒表面抗原(HBsAg)的特异性T细胞受体,定向清除HBV感染的肝细胞和肝癌细胞, TCR-T细胞疗法将自体T细胞受体经过基因编辑导入细胞,从而具有更高的敏感性和结合力,且排异性更低。
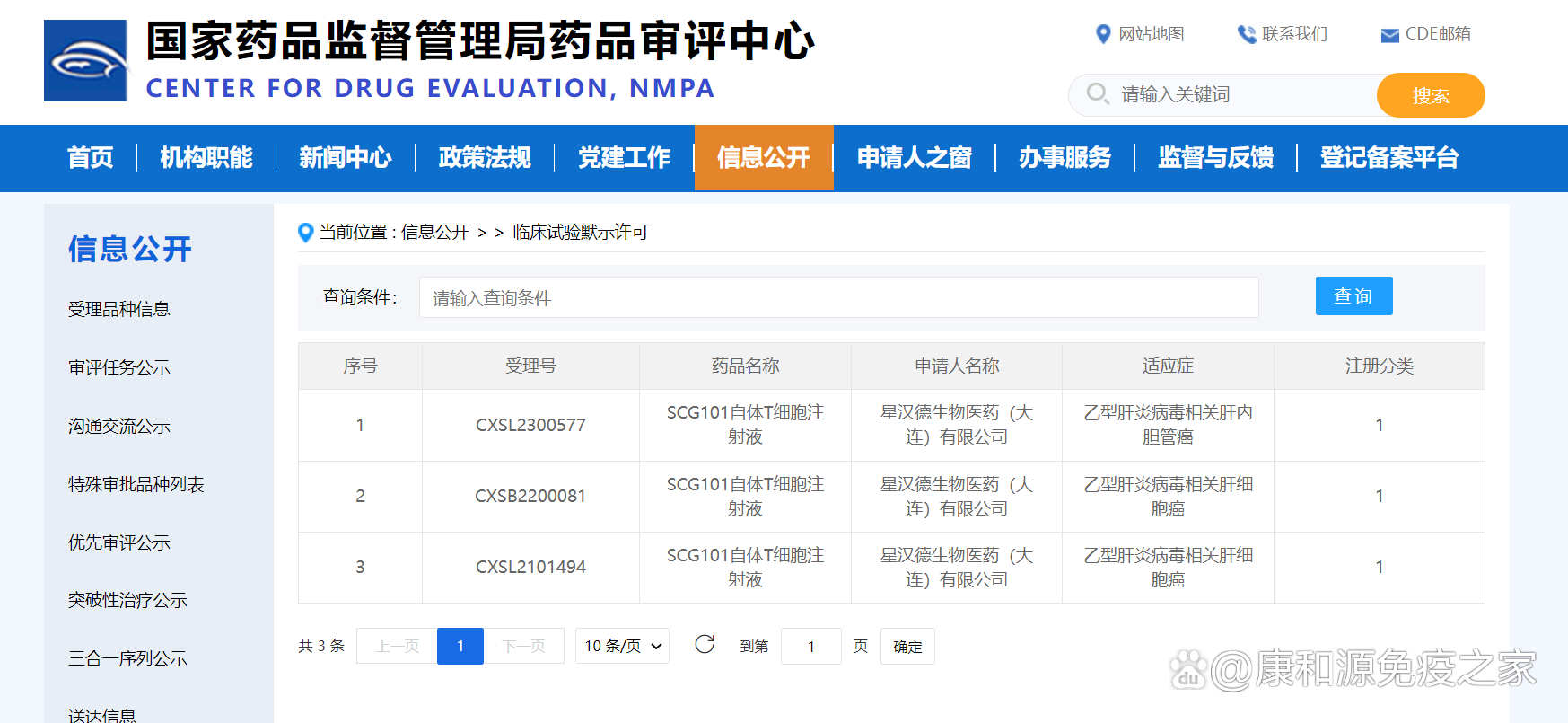
2022年3月10日,中国国家药品监督管理局药品审评中心(CDE)公示显示,SCG101自体T细胞注射液成功获得临床试验默示许可,用于治疗乙型肝炎病毒(HBV)相关的肝细胞癌(HCC)。
2023年6月5日SCG细胞治疗有限公司(SCG)在法国巴黎举行的国际细胞与基因治疗学会(ISCT)会议上,展示了其一流的自体HBsAg特异性T细胞受体工程T细胞(TCR-T)疗法—SCG101的最新突破性数据。SCG101显示出显著的抗肿瘤活性,单剂量SCG101单药治疗后,每mRECIST肿瘤减少74.5%。数据截止时,肿瘤反应持续时间为6.9个月。治疗前和治疗后的活检显示肝脏中HBsAg+肝细胞100%根除。血清HBsAg从基线时的557.96 IU/mL降至第7天的1.3 IU/mL,在SCG101输注后的第28天进一步降至0.08 IU/mL (3.83log降低)。
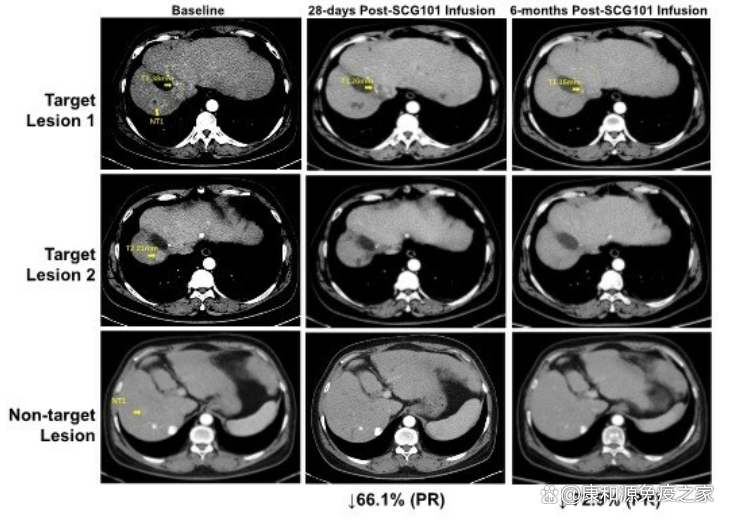
2023年11月13日,SCG细胞治疗有限公司(SCG)在美国波士顿举行的美国肝病协会(AASLD)上宣布了其首创的自体乙型肝炎病毒(HBV)特异性T细胞受体工程T细胞(TCR-T)疗法SCG101的最新临床数据。一项首次人体临床试验的结果表明,SCG101在晚期HBV相关肝细胞癌(HCC)患者中显示出有希望的抗病毒和抗肿瘤活性。6例晚期HBV肝细胞癌患者接受了TCR+T细胞输注,2例患者达到部分缓解(PR),2例患者疾病稳定(SD)并观察到肿瘤缩小。
综上,SCG101在乙型肝炎相关肝癌的治疗中,展现出显著的抗肿瘤活性。
关于TC-N201
TC-N201注射液是一款TCR-T产品。该产品除了改造T细胞上的TCR外,还加入了PD-1,这使得经过改造的T细胞能够被激 活产生肿瘤杀伤作用的同时,分泌出PD-1抗体从而消除肿瘤微环境的抑制,达到双管齐下的效果,从而提升TCR-T细胞对实体瘤的疗效。
2022年11月28日,由广东天科雅生物医药科技公司研发的一款TCR-T产品—“TC-N201注射液”的临床试验申请(IND),获国家药监局审查中心批准,用于治疗既往治疗失败的复发或者转移性实体瘤(LA-A2和NY-ESO-1阳性)。

关于CRTE7A2-01 TCR-T细胞注射液
CRTE7A2-01 TCR-T细胞注射液是由北京可瑞生物科技有限公司开发的免疫细胞治疗产品,该产品的适应症是HPV16阳性HLA-A*02:01阳性晚期实体肿瘤(宫颈癌、头颈部肿瘤、肛门癌和其他肿瘤类型)。
2023年11月21日,深研生物战略合作伙伴北京可瑞生物科技有限公司自主研发的TCR-T产品“CRTE7A2-01 TCR-T细胞注射液”获得国家药品监督管理局药品审评中心(CDE)新药临床试验(IND)默示许可。

Afami-cel
最让人期待的莫过于即将上市的Afami-cel了。1月31日,Adaptimmune Therapeutics公司宣布,美国食品药品监督管理局(FDA)已经接受了其工程化T细胞受体(TCR)T细胞疗法afamitresgene autoleucel(Afami-cel)的生物制剂许可申请(BLA),并授予其优先审评资格。该申请的目标日期为2024年8月4日。
在SPEARHEAD-1试验中,患者的总体客观缓解率(ORR)约为39%。该产品的中位反应持续时间(DOR)约为12个月,表明该药的持久性。中位总生存期(mOS)约为17个月,而既往接受过二线或更多线治疗的滑膜肉瘤患者的中位总生存期<12个月。此外,70%对Afami-cel有反应的晚期滑膜肉瘤患者中在治疗两年后仍然保持存活。
如果Afami-cel成功获批,那么将为该患者群体提供具有更高生活质量的替代治疗。
总体而言,TCR-T 细胞免疫疗法已在实体肿瘤的治疗中取得了较好的疗效,尤其是对黑素瘤、滑膜肉瘤、肝细胞癌的治疗有明显效果。随着TSC-100和TSC-101Ⅰ期临床结果的公布,也让我们看到了TCR-T疗法在血液肿瘤领域的应用潜力。希望免疫治疗能够尽快取得更加辉煌的战绩,也希望我们国产的抗癌药能有更多价格亲民的抗癌好药让更多的癌友患者获益。
免责声明:康和源免疫之家为免疫科普平台,文本参考来源于网络,版权归原作者所有。
该文章仅供分享,如涉嫌侵犯您的著作权请联系我们删除,谢谢!
参考资料
1.TScan Therapeutics Presents Promising Updated Phase 1 (globenewswire.com)
2.TScan Therapeutics Announces Poster Presentations at the 63rd American Society of Hematology Annual Meeting and Exposition | TScan Therapeutics, Inc.
3.Initial Results of a Phase 1 Trial of TSC-100 and TSC-101, Engineered T Cell Therapies That Target Minor Histocompatibility Antigens to Prevent Relapse after Allogeneic Hematopoietic Cell Transplantation - ScienceDirect
